補體調節分子的結構及功
補體系統的激活為一種級聯反應����,但受到多種調節分子的嚴格控制�,其反應的程度和單一成分的反應都是在生物反饋近代制下而進行的���,從而限制了活化的擴大化��,以維持補體水平的平衡�����。調節作用包括兩個方面�����,即自身衷變失活及一些抑制物的滅活作用。前者指已活化的補體分子均不穩定��,如不及時與靶細胞膜結合即迅速衰變失活�����;后者是通過抑制物的作用而使已活化的分子失去活性�。這一節中僅涉及后一個方面。
一�、C1抑制物
C1抑制物(C1INH)是血清中高度糖基化的一種蛋白質,含糖量高達35-49%�。*初由Ranoff和lepow(1957)所發現,稱其為C1酯酶抑制劑�����,與引同時Schultze等則將其稱為α2神經氨酸糖蛋白����。C1INH為一單鏈分子,由478個氨基酸殘基組成��,分子量為104kDa��,由478個氨基酸殘基組成,分子量為140kDa����,鏈內有兩對二硫鍵(圖5-13)。C1INH調節的主要方式是�����,與活化的C1r或C1s結合形成穩定的復合物而導致C1絲氨酸蛋白酶失活���。其作用機理是����,C1INH通過提供一個酷似C1r或C1s的正常底物的序列為“銹鉺”(“bait”)�,被c 1r或C1s裂解暴露出一個活性部位,然后再與C1r或C1s結合形成共價的酯鍵而發揮抑制作用�。此外,C1INH還可防止在缺乏抗體時����,C1以很低但仍有一定速率出現的自發激活��。正常情況下���,血液中的大多數C1可被7倍于其克分子濃度的C1INH所結合����,以防止C1由于構象改變而引起的自發激活。但C1同抗原���、抗體復合物的結合����,可使C1從C1INH的抑制作用中而獲釋���。除上述作用外���,C1INH還可抑制凝血因子Ⅻa、Ⅺa���、激肽釋放酶及纖溶酶����,因而其在凝血��、激肽和纖溶系統中也有重要的調節作用�。
經對C1INH cDNA序列的分析發現���,C1INH與其它幾種絲氨酸蛋白酶抑制物(serpin)超家族成員(α1抗胰蛋白酶、α1抗糜蛋白酶及抗凝血酶Ⅲ等)約有30%的氨基酸同源性����,物別是在C端的120個氨基酸。C1INH的編碼基因定位于第11號染色體的短臂11.2~長臂13亞區�。C1INH先天性缺陷時,可導致遺傳性血管神經性水腫(hereditary angioneurotic edema,HAE)���。近年報道應用C1INH濃縮劑防治HAE效果良好��,但尚未廣泛用于臨床�。
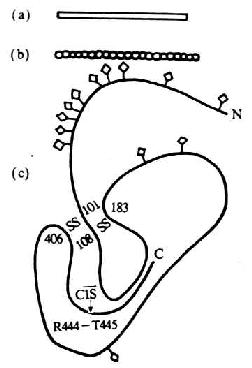
圖5-13 C1 INH分子的結構模式圖
注:(a)為電鏡觀察模式圖
(b)為中子散射模式圖
(c)為園二色譜分析的二級結構模式圖
二�����、C4結合蛋白
C4結合蛋白(C4bp)是一種含量豐富的可溶性血清糖蛋白�����,分子量為550kDa�����,1977年由Ferreira等所報道�����。其分子結構模式現多以Dahlback等(1983)描述的“蜘蛛樣”(spiderlike)結構來分析其結構及功能����。C4bp由8個亞單位組成,電鏡下觀察形似蜘蛛����,其中有7條分子量相同(均為70kDa)的長鏈(α鏈),由549個氨基酸殘基組成���,鏈間以二硫鍵相連結�,并共同氨基酸殘基組成�,鏈間以二硫鍵相連結,并共同連結于一中心體����。α鏈含有8個SCR,其N端是其頭部���,為與C4b相結合的部位�����,可能位于第332-395位氨基本酸殘基�。第8條鏈(β鏈)較短(45kDa)由235個氨基酸殘基組成,含有4個SCR為與蛋白S(PS)相結合的部位(圖5-14)��。C4bp以兩種方式抑制補體的活化���。**種方式是����,通過其與C2競爭C4b��,而從c 4b2a中取代C2a�����,并通過其與C4b的結合而陰止剩余的C2同C4b結合���,由此抑制C3轉化酶的形成�����。C4bp與C4b的結合能力與細胞表面C4b分子的數成正比���,且較C2同C4b的結合能力高27倍。**種方式是����,C4bp作為I因子的一種輔助因子,促進I因子對C4b的裂解���。有C4bp存在時���,I因子可將C4b的a`鏈完全裂解;無C4pb時��,I因子的裂解作用不完全���。其與I因子結合的活性部位位于第177-322位氨基酸殘基區域��。PS與C4pb的第8條鏈(β鏈)結合�,不影響C4bp同C4b的結合�����,但可延長C4bp的半衷期,從而強化C4bp的抑制作用�����。
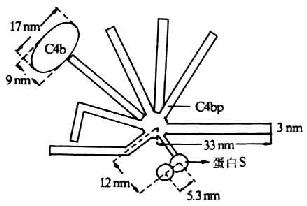
圖15-14 C4bp的結構(模式圖)
C4bp基因定位于人的第1號染色體長臂32區���,同CR1����、CR2�、H因子、MCP及DAF等的基因相連鎖����,并均含有數目不同的SCR。
三��、促衰變因子(CD55)
促衰變因子(decayaccelerating factor,DAF)是Nicholson-Weller等(1981)用正丁醇提取后�,再以層析法從人和豚鼠紅細胞基質中純化的一種膜蛋白。因其具有促進C3轉化酶衷變的活性故名���。經在還原條件下做SDS-PAGE并以過碘酸-Schiff試劑染色表明�,純化的DAF為單鏈膜糖蛋白��。人和豚鼠的DAF分了量不同分別為70kDa和60kDa。現已按白細胞分化抗原將其歸為CD55���。Davitz等(1986)通過用磷脂酰肌醇(PI)特異性的磷脂酶C(PI-PLC)處理人外周血細胞可釋放DAF的事實探明��,DAF是經糖磷脂酰肌醇(glycosylphodphatidylinositol,GPI)錨而固定于細胞膜中的���。即糖蛋白的C末端共價結合于含PI的糖磷脂上����,再經PI插入細胞膜脂質雙層的外層小葉中。研究表明��,膜DAF的遷移率接近于膜類脂的遷移率����,比大多數膜蛋白遷移率高一個數量級。認為這有助于促進數目有限的膜DAF分子與細胞表面大量的C3b或C4b片段接觸���。另外DAF的糖磷脂酰肌醇結構還可能具有轉導細胞信號的作用����。
除Nicholson-Weller等證實的分子量為70kDa的膜DAF外����,Kinoshita等(1987)用Western blotting在人紅細胞表面還檢出分子量為140kDa的一種膜DAF�����,稱其為DAF-2�。DAF-2在膜上的數目不足70kDa膜DAF的1/10�����,但也有促進C3b轉化酶衰變的活性�����,也含有GPI錨結構�����。由于DAF-2的分子量較70kDa的膜DAF大一倍�,提示其為膜DAF的二聚體,但用二巰基乙醇或以SDS使基變性��,都不能將DAF-2裂解成兩個成分�����,故DAF-2的**結構仍有待進一步闡明。另外�����,近年應用兩位點RIA測定法����,在血漿、尿液�����、淚液����、唾液���、滑膜液和腦脊液��,以及組織培養上清中均檢出可溶性的DAF(sDAF)��,水平的40-400ng/ml范圍���。并發現尿液中的sDAF分子量略低于紅細胞上膜DAF的分子量���,疏水性也較膜DAF小,其抑制細胞表面C3轉化酶內在裝配的活性較膜DAF約低100倍��,但仍具有促進已形成的C3轉化酶衰變的作用���,效能類似于C4bp����。
膜DAF廣泛分布于各種血細胞及其他各處的細胞上��,包括紅細胞����、粒細胞、單核細胞��、**細胞(T��、B)��、血小板����、骨髓單個核細胞�、紅細胞的始祖細胞���,角膜���、結合膜、消化道粘膜�、外分泌腺、腎小管��、膀胱��、**粘膜��、胞膜�����、心包及滑膜的上皮細胞����,精子���,以及培養的臍靜脈內皮細胞上��。但NK細胞上則缺如�。陣發性血紅蛋白尿(paroxysmal nocturnalhemohlobulinuria,PNH)病人的紅細胞上也缺少DAF,并以缺乏程度將該病分為三個型����。PNH病人的紅細胞對補體介導的溶血作用高度敏感,就是由于紅細胞上缺乏DAF及基它含GPI錨的分子而引起的��。DAF帶有Cromer抗原����。極少數稱之為Inaba或IFC缺乏的Cromer相關抗原的個體也缺乏DAF。
DAF生物學活性及生理功能已虱到充分證實��。它可保護宿主細胞免遭補體介導的溶解破壞���。其作用機理是�����,DAF不僅可阻止經典或替代途徑C3和C5轉化酶的裝配���,并且可通過誘導催化單位C2a或Bb的快速解離而使已形成的C4、C5轉化酶失去穩定性,從而抑制補體攻擊單位的活化(圖5-15)�����。DAF的這種抑制作用**于直接結合在細胞上的C3��、C5轉化酶���,也即DAF不抑制靶細胞上正常的補體激活劑如微生物和**復合物����。但DAF不能作為I因子裂解C3b和C4b的輔因子而發揮作用���。另外�����,DAF雖不能阻止C2和B因子(分別通過與C4b或C3b結合)與細胞的*初結合�,但卻可使C2a或Bb由它們結合的部位解離出來��,以而阻止C3轉化酶的裝配��。
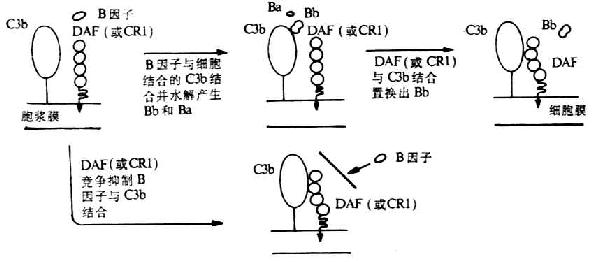
圖5-15 DAF抑制替代途徑中C3轉化酶形成的的機理
編碼人DAF的基因位于第1號染色體的長臂上32區一個800kb片段內��,與其它幾種補體激活調節劑(RCA)的基因緊密連鎖�,排列順序依次為:MCP-CR1-CR2-DAF-C4bp。其中DAF基因的長度約為C4bp��。其中DAF基因的長度約為35kb�,以限制性酶譜分析表明為一單拷貝基因。在DAF基因的非編碼區還有3個限制性酶切片段長度多態性(RFLP)結構���,兩個為HindⅢ酶切位點���,1個為Bamh Ⅰ酶切位點。DAF的cDNA已克隆成功��,并進行了核苷酸和氨基酸序列分析����。關于DAf cDNA和膜糖蛋白的結構見圖5-16。DAF的cDNA結構從5`端開始依次為:信號肽區�����、四個SCR(長度1143bp)�、富含絲氨酸與蘇氨酸(S/T)的區(約70個氨基酸)及疏水區,*后終止于3`端的poly(A)�。由cDNA推導的氨基酸序列得出DAF蛋白由381個氨基酸所組成,包括34個氨基酸的信號肽,富含S/T的區為DAF中大多數延伸的O-連接的糖基化部位��。SCR中有1上N-連接的的糖基化部位�。C末端的疏水區在翻譯后被糖磷脂所取代,為DAF分子與細胞膜相結合的部位�����。
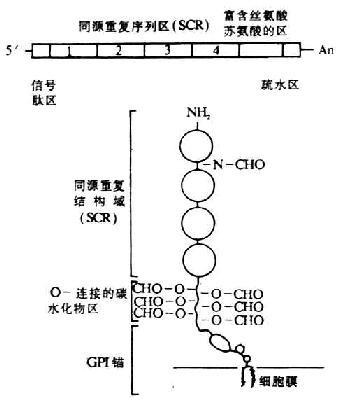
圖5-16 DAF cDNA和其膜糖蛋白的結構
