補體固有成分的分子結構及功能
補體系統兩條激活途徑中,涉及到14個補體蛋白(C1-9���,及B��、D����、P因子)的參與����。近年來,由于分子遺傳學和分子克隆技術的應用,已闡明許多補體分子的結構�、功能、生物合成及遺傳特征�����,從而大促進了人們對補體系統激活過程機理的認識和對各個補體分子功能的深入了解�����。
一����、C1分子
C1是經典激活途徑中的起始成分。它是由1個分子的C1q和2個分子的C1r及2個分子的Cls借Ca2+連接而成的大分子復合物���。分子量約為750kDa�����。其中C1q為具有識別作用的亞單位�,C1r和C1s為具有催化作用的亞單位����。
(一)C1q
C1q為各種補體分子中分子量*大(410kDa)的γ球蛋白�。其分子結構較特殊和復雜���,由A���、B、C三種不同類型的肽鏈所組成����。其中A、B�、C鏈各6條,共18條��。A���、B�、C三種肽鏈的分子量不盡相同���,分別為24����、23和22kDa�����,各含有222-226個氨基酸殘基����,且彼此同源。每條肽鏈由含半胱氨酸殘基的一個短的N末端區所組成����,接著為一段81個氨基酸的膠原序列(即重復的三股序列Gly-X-Y,Y處通常為羥脯氨酸或賴氨酸殘基)。該序列的其余部分為非膠原性的��。A��、B鏈間及兩條C鏈間各有一個二硫鍵相連接���。18條肽鏈中每三條不同的肽鏈組成一條三股螺旋��,故共有6條這樣的結構��。每條螺旋的肽鏈均由絲狀膠原樣成分組成��。在6條螺旋結構C端由于氨基酸序列的隨機卷曲而形成6個花蕾狀的球形頭部�,呈花朵形展開���。在近N端約為1/2全長的螺旋結構呈束狀并平行排列���,其N末端為C1q的尾部����。因此在電鏡下觀察��,C1q分子的圖像酷似一束盛開的郁金香花(圖5-1)
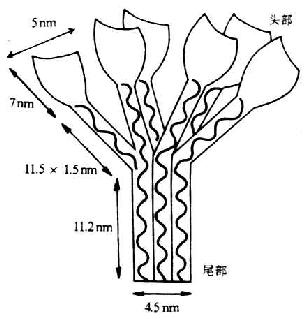
圖5-1 C1q的結構(模式圖)
C1q的膠原樣區有結合C1r和C1s的部位��。并證實聚合的C1q刺激B細胞增強其產生Ig的作用��,也是通過其尾部而完成的���。C1q的關部含有能識別IgFc片段上補體結合部位的位點(C1q與C1q-R相互作用)�,且由于6個球形頭部呈花朵形展開��,更增加了其與Ig接觸的機會����。C1q同1個分子的IgM結合即可被活化,但至少需同兩個IgG分子結合才能被活化���,而且兩個IgG分子在細胞膜上的距離不得少于700nm���。C1q對人4種IgG亞類的結合親和力依次為:IgG3>IgG1>IgG2>IgG4。
Reid等已對C1q分子的A���、B鏈做了部分氨基酸分析�,并完成了A�����、B鏈的cDNA克隆及序列分析��。因此���,C1q分子的大部分**結構已經明確����。編碼C1qA�、B、C三條肽鏈的基因均定位于人的第1號染色體的短臂34.1-36.1區��。
(二)Clr和Cls
Clr和Cls均為單一多肽鏈分子�,又都是絲氨酸蛋白酶(原)。Clr和Cls 多肽鏈均由接近700個氨基酸所組成��。位于C末端的約250個氨基酸為絲氨酸蛋白酶區,與胰蛋白酶和糜蛋白酶同源��。同大多數補體蛋白一樣��,它們都是鑲嵌(mosaic)蛋白�,即由不同氨基酸組成的固定基序組合而成,并且很可能代表獨立的折疊功能區或結構功能域(module)���。
電鏡下觀察表明����,Clr和Cls的分子構型極為相似��,均呈一端大一端稍小的啞鈴狀分子��。
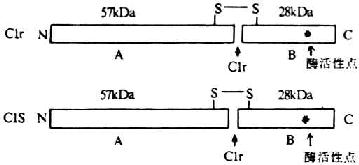
圖5-2 Clr/Cls分子的結構
兩個分子的Clr和同等分了的Cls借Ca2+連接成扭曲的“8”字形���,盤架于C1q近頭部的6條螺旋結構間(圖5-3)�����。Clr和Cls的分子量條螺旋結構間(圖5-3)����。Clr和Cls的分子量均為85kDa。它們激活后��,在分子內的精氨酸與亮氨酸殘基間斷裂���,形成分子量分別為57kDa和28kDa的A、B兩個片段�,但鏈間仍以二硫鍵相連接,故整個分子并末分離����。在B片段上含有絲氨酸蛋白酶活性點,為其催化英勇區(圖5-2)���。A片段上有Clr和Cls相互反應的的功能區����。反應功能區朝向中心���,催化功能區位于外側�。在一般C1INH與C1r結合著��,而一旦有**復合物結合到Clq時,C1INH的抑制作用即行移除���,并通過C1q的膠原性柄將其頭部的移動傳遞到其核心區���,并從此處再傳遞到與其相連接的C1r,誘導C1r構鐘愛改變并裂解活化�。活化的C1r(C1r)�����,再作用于C1s使之成為活化型C1s(C1s)����。
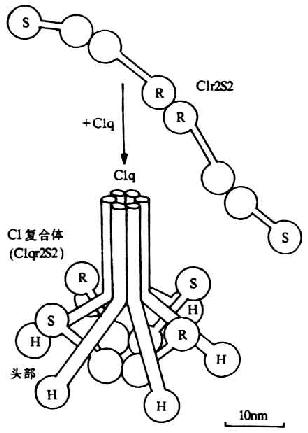
圖5-3 C1分子(C1q�、C1r和C1s)的結構(示意圖)
目前C1r和C1s的cDNA克隆均已成功,并進行了全部序列分析�����。編碼C1r的基因定位于人的第12號染色體短臂13-ter�,與編碼C1s的基因相連。
二���、C4分子
C4是經典激活途徑中**個被活化的補體成分����,分子量約為210kDa,由α(90kDa)��、β(78kDa)及γ(33kDa)三條肽鏈借二硫鍵連接組成(圖5-4)C4的分子結構較為特殊�,其α鏈中含有一個在半胱氨酸和谷氨酸殘其間形成的內硫酯鍵。α鏈的N端有C1s絲氨酸蛋白酶的作用點�。當C1s將C4α鏈的精氨酸-丙氨酸鍵(76-77位)裂解后�,形成大小不等的兩個片段。小片段C4a(8.6kDa)釋放入液相中��,其為一弱的過敏**���,具有激酞樣作用���,可誘導肥大細胞釋放組胺,增加血管的通透性引起局部滲出性炎癥��,但其活性不到C3a或C5a的1%����。大的片段C4b其α`鏈的內硫酯鍵被水解���,并暴露出一個自由的硫氫基和一個谷氨酰胺殘基的高度反應性酰基�����,通過轉酯反應而將C4b固定到膜固相上�。但C4b只能在其產生處或附近部位結合,因高度反應性的?��;苎杆倥cH2O反應�����,生成穩定的無共價結合功能的羧基(詳見圖5-7)�����。
一個C1s絲氨酸蛋白酶可以裂解多個C4分子����,但產生的C4b只有1/10能結合到膜固相上�����,而且其中也僅少數與C2結合。C4b的功能�����,除主要參與經典激活途徑中C3轉化酶(C4b2a)和C5轉化酶(C4b2a3b)的形成進一步介導補體后續成分的級聯反應外��,還可通過與效應細胞膜上的CR1結合促進吞噬����、調節補體活化,以及參與防止**復合物的沉積及中和病毒的作用��。近年認為���,C4可能與**識別及維持**自穩功能也有關。
編碼人C4的基因定位于第6號染色體的HLA-DR和HLA-B位點間一段基因組DNA上�����。C4由兩個基因C4A*和C4B*所編碼�,因此血清中的C4分子也有兩種類型即C4A和C4B,但二者具有高度同源性(僅有少數氨基酸不同)目前C4A*和C4B*的cDNA克隆均已成功并進行了序列分析���。C4A��、C4B�����、B因子及C2均屬于MHC的第Ⅲ類分子�����。
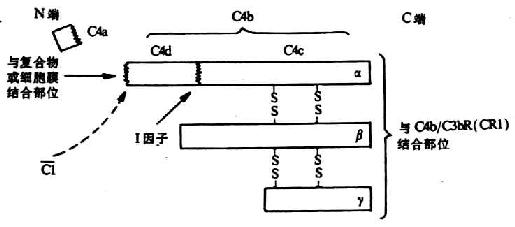
圖5-4 C4分子其裂解片段(模式圖)
